代謝変化がプロテオスタシス容量を調節する仕組みを解明(医化学分野)
R. Takii, M. Fujimoto, K. Tan, E. Takaki, N. Hayashida, R. Nakato, K. Shirahige, and A. Nakai. ATF1 modulates the heat shock response by regulating the stress-inducible HSF1-transcription complex. Mol. Cell. Biol. in press (published ahead of print 13 October 2014 , doi:10.1128).
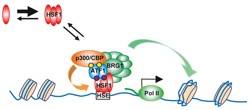
細胞内のプロテオスタシス容量は、様々な環境条件や代謝状態でも熱ショック応答などの遺伝子発現機構によって維持されている。これまでに、熱ショック応答を制御する熱ショック因子HSF1が、代謝ホメオスタシスを調節することが示唆されていた。今回、私たちは、逆に、代謝変化がHSF1により構築される転写環境にどのように関与するかを解明したいと考えた。そのために、ヒトHSF1と相互作用するタンパク質群の網羅的同定と機能解析を行い(Fujimoto et al, Mol. Cell 2012)、糖及び脂質代謝ホメオスタシスを担うATF1/CREB転写因子ファミリーが、HSF1転写複合体の構成要素の一つであることを見いだした。
ストレス刺激後のHSF1転写複合体には、クロマチン再構成因子BRG1やリジンアセチル化酵素p300/CBPなどのコアクチベーター群が集積するが、この過程がATF1及びそのリン酸化に依存した。ATF1-Ser36/41の構成的なリン酸化はHSF1-ATF1の相互作用とBRG1のリクルートに必要であった。したがって、このリン酸化なしでは、HSP70などの誘導性遺伝子発現が減弱した。また、ATF1-Ser63は、代謝刺激などでリン酸化され、p300/CBPのリクルートに必要であった。このp300/CBPのリクルートは、HSF1のアセチル化による不活性化を介して、HSP70発現の速やかな回復に必要であることが分った。ChIP-seq法を用いたゲノムワイドな結合領域の解析から、HSF1結合領域の約30%は、ATF1の結合領域でもあり、ATF1によるHSP群の発現調節は、ストレス条件下での細胞の生存や不良蛋白質の蓄積に大きな影響を与えた。
これらの結果は、代謝変化がHSF1を介してプロテオスタシスを修飾する仕組みの一端を示した。そして、進化の過程で保存されたHSF1が、細胞内の代謝変化に適応するためにより複雑な転写複合体、及びその調節機構を備えたことを明らかにした。